Pour éviter l'apparition de symptômes et potentiellement mettre fin à l'infection virale par le sars-cov-2, ou pour être administrés après apparition de symptômes dans le but de mitiger l'infection, différents médicaments antiviraux vont agir à plusieurs échelles.
D'une part, on limite l'infection en empêchant donc la cellule d'être infectée. Cela peut passer par le blocage de la liaison à la membrane (interaction ACE2 / Spicule), par le blocage de la fusion membranaire ou encore par une compétition, en ajoutant par exemple des récepteurs ACE2 libres. Une fois qu'il y a eu fusion membranaire, le virus va entrer à travers un endosome, on peut encore cibler le trafic intracellulaire pour empêcher le virus de progresser, mais il commencera le processus de réplication.
D'autre part, on limite la phase de réplication. Le virus va injecter un ARN dans la cellule, un livre de recettes pour fabriquer à nouveau du virus contenant enveloppe qui entoure le virus, nucléocapside qui permet d'empaqueter une copie d'ARN dans le virus, matrice permettant l'assemblage du virus et spicule permettant de se lier à la cellule ciblée.
Dans cette seconde catégorie, on va pouvoir cibler de multiples étapes de la réplication. En effet, l'ARN une fois entré va être tout d'abord lu, et va fabriquer une première grosse "mégaprotéine" qu'il va falloir découper en protéines fonctionnelles.
Cette fabrication est une première cible intéressante : elle implique l'utilisation de la machinerie de la cellule, et notamment les ribosomes, grosses usines qui lisent un ARN et fabriquent la succession d'acides aminés selon le code inscrit.
Un triplet (3 lettres de l'ARN va correspondre à un acide aminé (il en existe 20). Le ribosome va tout simplement lire l'ARN (en bleu) et permettre l'association des acides aminés dans la protéine naissante. Pour la curiosité, nous connaissons bien l'alphabet du génome, le voici (le U de l'ARN correspond au T de l'ADN) :
Une tactique pour bloquer la réplication du virus est de bloquer la fabrication de protéines en général. Mais cela a comme inconvénient d'empêcher le corps de fabriquer ses propres protéines et peut avoir des effets néfastes. Une approche est d'utiliser des acides aminés modifiés, qui bloquent la suite de la chaîne (par exemple, en ayant une "fausse" valine, on bloque la fabrication de la protéine entière dès qu'il faut une valine). Une autre est de gêner l'usine de fabrication, le ribosome, en général. Par exemple, on peut essayer d'ajouter des petits ARN complémentaires, qui vont se fixer sur cette séquence bleue en cours de lecture, et en empêcher la lecture. De même, les interférons interviennent de cette façon, en gênant la fabrication des protéines.
Une protéine est une succession d'acides aminés. Des "protéases" découpent une protéine lorsqu'elles reconnaissent une courte séquence d'acides aminés bien précise. Le corps en a besoin pour la maturation de ses propres protéines, et pour digérer certaines autres protéines. Les désactiver complètement risque de poser problème. Mais gêner leur activité peut ralentir la progression du virus qui commence par laisser la cellule infectée fabriquer sa grosse "mégaprotéine" puis la découper en sous-unités fonctionnelles.
Voici la structure générale de l'ARN du virus :
Les polyprotéines (pp) ont besoin d'être découpées et leur rôle est de créer des copies de l'ARN viral. Les autres éléments sont fabriqués dans le but d'empaqueter l'ARN (N : nucléocapside), de l''envelopper (E : enveloppe), de générer l'assemblage général du virus (M : matrice) ou d'ajouter le spicule (S : spicule) permettant l'infection.
Nous allons donc voir les différentes cibles des antiviraux, et leur efficacité. Pour bien commencer, voici une figure qui montre le lieu d'action des acteurs principaux :
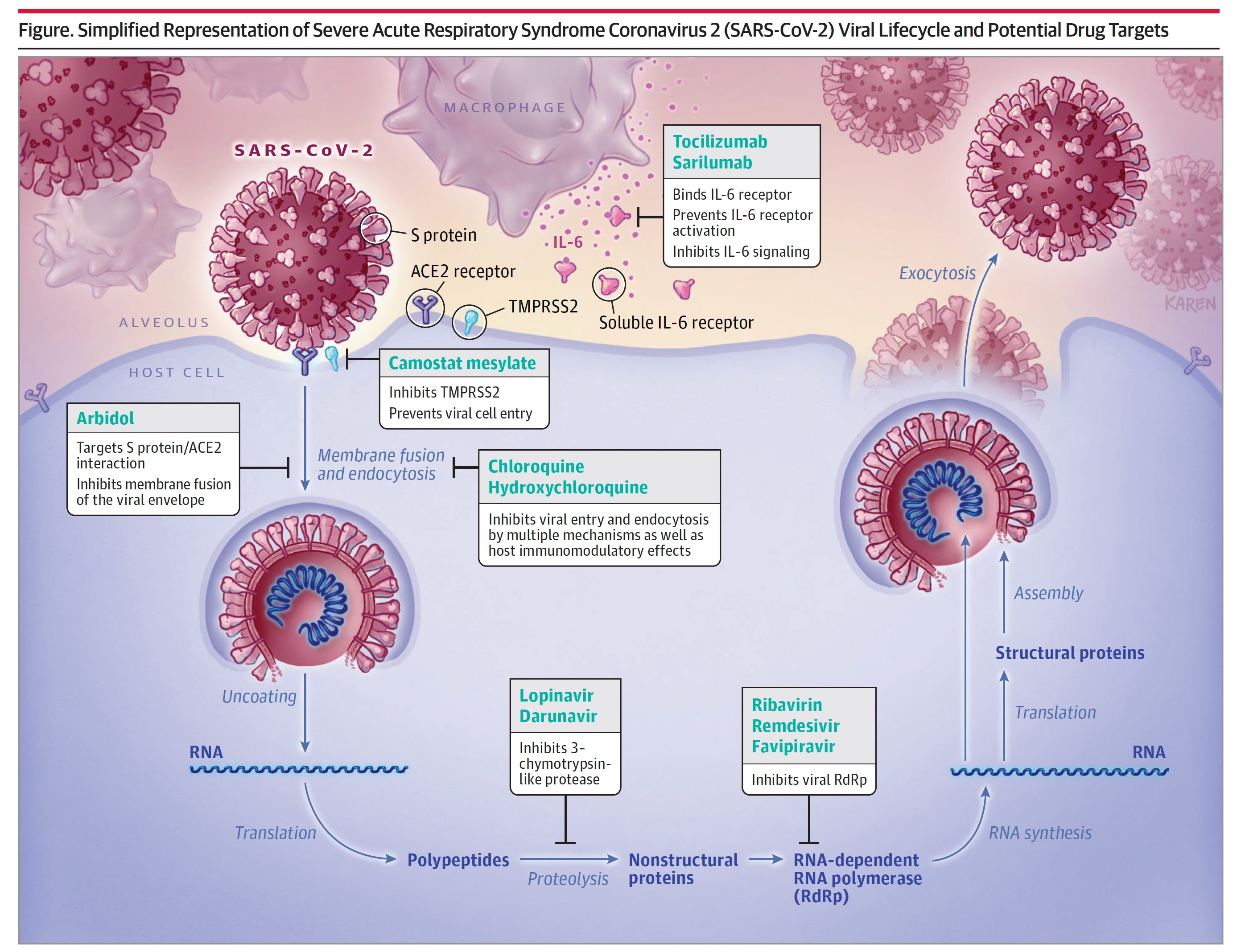
Une première approche est de gêner la liaison avec le récepteur ACE2 ciblé par le virus. Cela peut avoir des conséquences comme nous l'avons vu sur le système cardiovasculaire. Mais une des façons les plus évidentes est de "parasiter" le virus en lui envoyant des récepteurs sur lesquels il va se fixer sans raison, ou en bloquant l'accès à ACE2.

En fabricant des fragments du spicule se liant à ACE2 (RBD - receptor bindig domain), on peut occuper les ACE2 disponibles à la surface de la cellule et empêcher le virus d'y accéder (haut). Ceci peut également être fait grâce à des anticorps (ScFv single chain fragment). Enfin on peut également ajouter des récepteurs ACE2, ou même les fabriquer en doublets pour plus d'efficacité (bas). Certains anticorps semblent très prometteurs.
Des essais cliniques sont en cours sur les Angiotensin Receptor Blockers (ARB, bloquant le récepteur ACE2) et les inhibiteurs d'ACE (ACEi, inhibant la liaison aux récepteurs ACE), y compris en chine. Cependant, les effets sur le système cardiovasculaire semblent assez conséquents lorsqu'on cible le récepteur.
Pour les anticorps, le principe ayant été décrit, il existe des candidats provenant d'études faites sur l'ancien sars-cov, le coronavirus de 2002/2003. En effet, le récepteur était le même (ACE2) et le site de liaison RBD était assez similaire, on peut donc essayer les mêmes anticorps, ou en développer de nouveaux comme le recense une revue datant du 4 Avril.
Une étude a identifié d'autres candidats capables de bloquer ACE2 : chloroquine, émodine, promazine et nicotianamine. La première a été largement étudiée mais a fait l'objet de résultats truqués, ce candidat a donné des résultats peu concluants pour l'instant.
Un candidat intéressant est le camostat car il permet de ne pas directement toucher au récepteur ACE2, mais d'inhiber TMPRSS2, une protéase présente sur la membrane cellulaire. Cette protéase est indispensable pour l'entrée du virus dans la cellule, et représente donc une cible intéressante avec des effets secondaires moindres, le camostat étant un générique connu. Voici un schéma produit par l'équipe allemande qui insiste sur la ressemblance avec le mécanisme d'entrée de l'ancien sars-cov.

Une étude a identifié d'autres candidats capables de bloquer ACE2 : chloroquine, émodine, promazine et nicotianamine. La première a été largement étudiée mais a fait l'objet de résultats truqués, ce candidat a donné des résultats peu concluants pour l'instant.
Un candidat intéressant est le camostat car il permet de ne pas directement toucher au récepteur ACE2, mais d'inhiber TMPRSS2, une protéase présente sur la membrane cellulaire. Cette protéase est indispensable pour l'entrée du virus dans la cellule, et représente donc une cible intéressante avec des effets secondaires moindres, le camostat étant un générique connu. Voici un schéma produit par l'équipe allemande qui insiste sur la ressemblance avec le mécanisme d'entrée de l'ancien sars-cov.

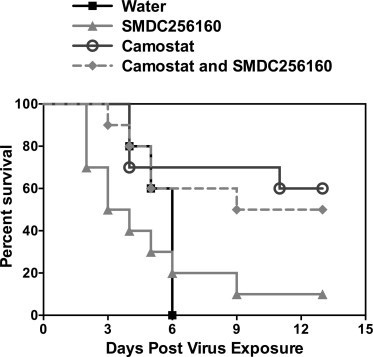
Cependant, certaines approximations ont été faites. Notamment, le camostat est à l'origine un inhibiteur de la trypsine et non de TMPRSS2. Une étude a montré qu'il n'empêchait l'entrée virale que si TMPRSS2 était exprimé, pas en son absence, mais sans réellement montrer de mécanisme d'action directe du camostat sur TMPRSS2. Il a fallu une concentration très élevée (micromolaire) pour une molécule qui ne reste pas longtemps dans l'organisme (une minute de demi-vie). Ce qui jouerait encore en faveur de ce candidat est qu'il a permis un meilleur taux de survie sur des souris infectées avec un coronavirus.
Enfin comme nous l'avons vu dans les différentes voies d'entrée du virus, le meplazumab pourrait agir sur une voie d'entrée alternative du virus passant par CD147. Cependant, il semble plus probable que ce soit le nucléocapside qui s'y lie, lors de l'assemblage du virus.
Un essai clinique a donné des résultats encourageants. 17 patients traités contre 11 contrôle, avec certaines disparités d'âge (plus jeunes chez les traités) de sexe (plus d'hommes chez les traités) et de comorbidités (davantage chez les traités). La charge virale a été réduite plus rapidement :
Ce qui a permis de libérer les patients de l'hôpital plus vite :
Avec une amélioration plus rapide du scanner pulmonaire :
Et une accalmie de leur système immunitaire plus rapide (lymphocytes en A et CRP en B) :
2) Action au niveau du transport intracellulaire
L'entrée du virus passe par une endocytose, création d'une vésicule d'entrée dans la cellule impliquant la formation à sa surface d'un manteau de clathrine. La Chlorpromazine bloque cette agrégation de clathrine et permet donc de réduire l'entrée virale, tout en ayant un effet global sur l'organisme pouvant avoir de lourds effets secondaires.
Un candidat encore moins prometteur est l'Arbidol, qui est un antiviral à large spectre supposé bloquer l'endocytose, et donc l'entrée du virus. Cependant, malgré sa découverte dans les années 70 en Russie soviétique, il n'a jamais fait l'objet d'études cliniques sérieuses et est l'objet de nombreuses promotions commerciales depuis longtemps en Russie. Il a, à l'instar de la chloroquine en France, fait l'objet d'une campagne promotionnelle sans grands résultats en Italie. Il a fait l'objet d'une étude comparative randomisée avec 120 patients, comparé au favipiravir, et son efficacité a été légèrement inférieure à celle du favipiravir. L'arbidol a également donné de très mauvais résultats associé au Kaletra (lopinavir/ritonavir), puisqu'en son absence l'issue clinique était beaucoup plus favorable dans une étude à très faible effectif (33 patients, 16 recevant le traitement C combiné et 17 le traitement Kaletra seul M) : la charge virale était diminuée plus rapidement sans arbidol

Le scanner devenait négatif au jour 7 dans une proportion plus large sans arbidol :

Un candidat encore moins prometteur est l'Arbidol, qui est un antiviral à large spectre supposé bloquer l'endocytose, et donc l'entrée du virus. Cependant, malgré sa découverte dans les années 70 en Russie soviétique, il n'a jamais fait l'objet d'études cliniques sérieuses et est l'objet de nombreuses promotions commerciales depuis longtemps en Russie. Il a, à l'instar de la chloroquine en France, fait l'objet d'une campagne promotionnelle sans grands résultats en Italie. Il a fait l'objet d'une étude comparative randomisée avec 120 patients, comparé au favipiravir, et son efficacité a été légèrement inférieure à celle du favipiravir. L'arbidol a également donné de très mauvais résultats associé au Kaletra (lopinavir/ritonavir), puisqu'en son absence l'issue clinique était beaucoup plus favorable dans une étude à très faible effectif (33 patients, 16 recevant le traitement C combiné et 17 le traitement Kaletra seul M) : la charge virale était diminuée plus rapidement sans arbidol

Le scanner devenait négatif au jour 7 dans une proportion plus large sans arbidol :

L'étape finale est la libération du virus nouvellement fabriqué. Dans le cas de la grippe, il doit d'abord être accroché à un récepteur contenant de l'acide sialique durant la phase finale de sa libération (en bleu). La neuraminidase présente sur le virus nouvellement fabriquée est une enzyme qui permet ce clivage. On utilise le Tamiflu (Oseltamivir), en essai clinique, ou encore la Nitazoxanide qui sont des inhibiteurs de la neuraminidase pour maintenir le virus accroché à la cellule et empêcher sa libération. Il est en essai clinique au Danemark.
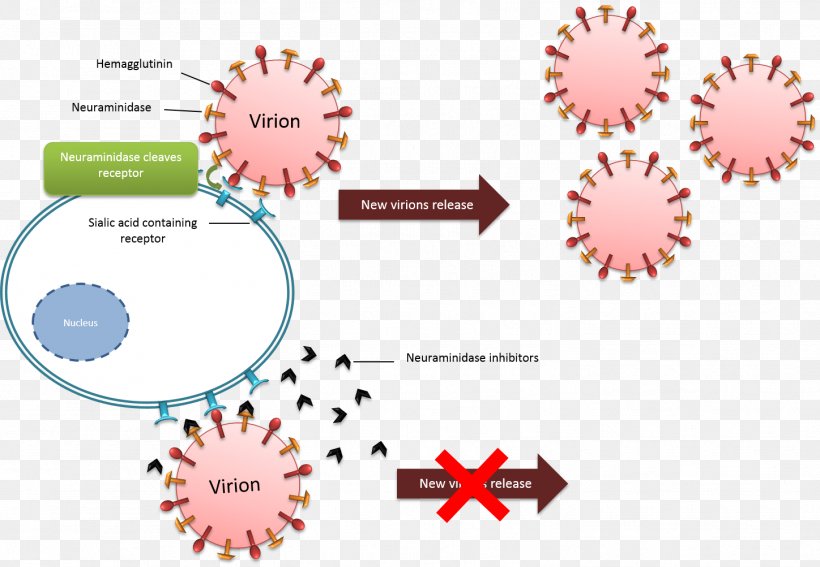
Cette piste est cependant très étrange, puisque le sars-cov-2 se lie au récepteur ACE2 et ne semble pas nécessiter de neuraminidase pour être libéré...
3) Action sur les protéases
Les protéases permettent de séparer les différentes unités fonctionnelles du virus. Elles reconnaissent une séquence d'acides aminés et vont cliver précisément à cet endroit. Ce clivage est parfois requis pour la maturation naturelle des protéines. Il peut donc affecter le bon fonctionnement de l'organisme.
Le principal traitement ciblant les protéases est le Kaletra (lopinavir/ritonavir, Abbvie), une combinaison contenant l'inhibiteur de protéases associé à une molécule le protégeant de la dégradation par l'organisme. Il fait l'objet de nombreuses études : 1, 2, 3, 4, comparé à de la médecine traditionelle chinoise, comparé à Arbidol, combiné avec ribavirine et interféron beta , comparé à ASC-09, comparé à ASC-09 2, comparé à ribavirine avec ou sans interféron alpha, comparé à l'hydroxychloroquine, comparé à Arbidol, comparé à la Carrimycine, encore la Carrimycine, comparé à Bictegravir (FTC/TAF), comparé à darunavir
Une première étude a présenté des résultats peu concluants mais tout de même favorables au Kaletra : le nombre de patients dont l'état de santé s'est amélioré a été compté en fonction des jours, avec l'application automatique du jour 28 pour les cas partis en réanimation ou décédés.
Cependant, la charge virale ne s'est pas réduite plus rapidement que chez le contrôle :
Aucun de ces résultats n'a été considéré comme étant une amélioration significative.
D'autres inhibiteurs de protéases sont également à l'essai : Bictegravir, Danoprevir, Danoprevir 2, Atazanavir, darunavir/cobicistat, Prulifloxacin, ASC-09, Nelfinavir, Cinansérine, Aprotinin, Topotecan, Diarylheptanoides et Flavonoïdes
4) Action sur la réplication
L'action sur la réplication risque toujours d'affecter globalement l'organisme. En effet, réduire la fabrication de virus peut impliquer de réduire toute fabrication protéique.
Une stratégie consiste à utiliser des analogues de nucléotides, pouvant parfois même induire des mutations, ou arrêtant net la réplication. L'ARN polymérase recopie l'ARN viral, en employant les nucléotides (A U G C) disponibles. Mais en ajoutant des nucléotides similaires, on peut perturber cette réplication.
C'est le cas de GD31, Leflunomide, Cidofovir, Gemcitabine, Ganciclovir, Azacitidine, Valaciclovir, Galidesivir, Filociclovir, EIDD-1931 et EIDD-2801.
Une autre stratégie consiste à empêcher la fabrication de nucléotides, notamment les pyrimidines (C et U) : Leflunomide, Brequinar; ou encore à en réduire la disponibilité : Dipyridamidole (A).
Enfin un candidat original a été proposé par une entreprise espagnole, et elle présentait des résultats prometteurs in vitro. Son mode d'action serait d'empêcher l'apport de ces briques en ciblant "eukaryotic elongation factor 1A2", impliqué dans l'apport de ces acides aminés aux ribosomes.
Un candidat extrêmement prometteur est le Favipiravir. Il induit des mutations en plus d'imiter un nucléotide (trop de mutations empêchent une quelconque évolution et rendent les copies non fonctionnelles).

Mis à disposition gratuitement pour des essais cliniques, il a été encore peu testé. Une étude retirée sans justification à la demande des auteurs avait été publiée. Elle concernait des patients traités soit avec favipiravir (35), soit avec kaletra (45). Une des limitations est un âge moyen un peu plus jeune chez les patients ayant reçu le favipiravir, mais dans des conditions randomisées, on obtient une amélioration bien plus rapide dans le groupe favipiravir :

Et ceci est d'autant plus notable lorsqu'on effectue un scanner du Thorax divisé en un groupe ayant eu une clearance virale à moins de 8 jours (à gauche) et celle n'en ayant pas eu avant 8 jours (à droite). Les barres noires indiquent un état en amélioration, les barres grises un état resté grave ou aggravé.

Une autre étude a comparé le favipiravir (116 patients) à arbidol (120 patients) avec une amélioration plus moins de femmes (49% contre 58%) mais plus de personnes âgées de moins de 65 ans (75% contre 66%) dans le groupe favipiravir. En 7 jours, les patients étaient bien plus nombreux à avoir un état de santé amélioré dans le groupe favipiravir. La fièvre et la toux disparaissaient en 4 jours maximum chez tous les patients, alors qu'il fallait plus de temps dans le groupe arbidol. L'étude a conclu en un effet marqué du favipiravir.
D'autres résultats cliniques pourraient parvenir d'essais comparatifs avec kaletra et baloxavir, baloxavir, kaletra et interféron alpha, ritonavir, à différentes doses, arbidol.
D'autres résultats cliniques pourraient parvenir d'essais comparatifs avec kaletra et baloxavir, baloxavir, kaletra et interféron alpha, ritonavir, à différentes doses, arbidol.
Un candidat un peu particulier est la Ribavirin (Mylan) qui a de multiples actions : en plus de réduire la disponibilité en nucléotides (G), elle va réduire les polyamines, induire des mutations dans l'ARN recopié et augmente l'expression des interférons.

L'autre cible permettant de réduire cette réplication virale est la polymérase, qui recopie l'ARN. Ici le candidat le plus connu est le Remdesivir (Gilead) qui semble se lier à la polymérase virale. Le tout premier cas de Covid19 aux Etats-Unis a été traité avec cette molécule. On a ainsi mesuré sa charge virale dans le temps (plus le Ct est élevé, moins il y a de virus) :
La charge virale a bien été réduite au cours du temps dans le cas de ce patient.
Parmi les 12 premiers cas arrivés aux Etats-Unis, trois ont reçu le remdesivir : les patients 6, 8 et 9 :
Le cours de la maladie est décrit ici avec en bleu une isolation à domicile, en jaune l'hospitalisation, en bleu l'oxygène et en pointillées roses les soins intensifs. La charge virale positive est comprise entre le " + " et l'étoile. Le losange rose indique la fin des symptômes et le carré noir la fin de l'isolation.
Une étude encore une fois sans groupe contrôle a exploré l'utilisation du remdesivir dans les cas graves. Malgré une amélioration dans l'oxygénation de 68% des patients, on déplore 60% d’effets secondaires, 23% d’effets secondaires graves, 8% menant à l’arrêt du traitement.
Il y a eu un total de 7 morts sur les 53 patients analysés, soit 13%, ce qui est en-dessous du taux de mortalité des cas sévères couramment admis à l'hôpital (par exemple une étude à Wuhan sur 201 patients a indiqué une mortalité à 22%). Voici les résultats cliniques triés selon l'oxygénation (invasive à air ambiant) :
Des études peu concluantes et non comparatives, ne donnant donc que très peu d'informations utiles en attendant les résultats de réels essais cliniques.
Une étude avec groupe contrôle, portant sur sur 155 personnes avec et 78 sans le Remdésivir. La proportion d'effets adverses était proche (à peu près 65% dans les deux groupes), mais les plus graves étaient plus nombreuses dans le groupe traité (12% contre 5% qui ont dû arrêter l'étude). Certains patients ont pris en plus du Kaletra (autant dans les deux groupes) ou des interférons (davantage dans le groupe contrôle). Les populations étaient globalement équilibrées, malgré quelques légères différences (davantage d'hommes chez le contrôle, davantage de comorbidités chez le groupe traité).
Aucune amélioration significative n'a été observée, et la charge virale n'a pas semblé diminuer plus vite :

La charge virale a bien été réduite au cours du temps dans le cas de ce patient.
Parmi les 12 premiers cas arrivés aux Etats-Unis, trois ont reçu le remdesivir : les patients 6, 8 et 9 :
Le cours de la maladie est décrit ici avec en bleu une isolation à domicile, en jaune l'hospitalisation, en bleu l'oxygène et en pointillées roses les soins intensifs. La charge virale positive est comprise entre le " + " et l'étoile. Le losange rose indique la fin des symptômes et le carré noir la fin de l'isolation.
Une étude encore une fois sans groupe contrôle a exploré l'utilisation du remdesivir dans les cas graves. Malgré une amélioration dans l'oxygénation de 68% des patients, on déplore 60% d’effets secondaires, 23% d’effets secondaires graves, 8% menant à l’arrêt du traitement.
Il y a eu un total de 7 morts sur les 53 patients analysés, soit 13%, ce qui est en-dessous du taux de mortalité des cas sévères couramment admis à l'hôpital (par exemple une étude à Wuhan sur 201 patients a indiqué une mortalité à 22%). Voici les résultats cliniques triés selon l'oxygénation (invasive à air ambiant) :
Des études peu concluantes et non comparatives, ne donnant donc que très peu d'informations utiles en attendant les résultats de réels essais cliniques.
Une étude avec groupe contrôle, portant sur sur 155 personnes avec et 78 sans le Remdésivir. La proportion d'effets adverses était proche (à peu près 65% dans les deux groupes), mais les plus graves étaient plus nombreuses dans le groupe traité (12% contre 5% qui ont dû arrêter l'étude). Certains patients ont pris en plus du Kaletra (autant dans les deux groupes) ou des interférons (davantage dans le groupe contrôle). Les populations étaient globalement équilibrées, malgré quelques légères différences (davantage d'hommes chez le contrôle, davantage de comorbidités chez le groupe traité).
Aucune amélioration significative n'a été observée, et la charge virale n'a pas semblé diminuer plus vite :

Malgré cela, Gilead a communiqué sur une étude menée sur 397 patients dans un état sévère, ayant reçu un traitement 5 jours ou un traitement 10 jours. Le nombre d'effets adverses était plus élevé chez les patients traités 10 jours.
Un test randomisé (538 patients traités) avec groupe placébo (521) a été réalisé, celui-ci indique un bénéfice dans les cas intermédiaires (C). Lorsque la maladie est peu sévère (A et B) ou très grave (D et E), l'effet est nettement moins marqué.
Un test randomisé (538 patients traités) avec groupe placébo (521) a été réalisé, celui-ci indique un bénéfice dans les cas intermédiaires (C). Lorsque la maladie est peu sévère (A et B) ou très grave (D et E), l'effet est nettement moins marqué.
Outre le Remdesivir, il existe plusieurs autres antiviraux agissant sur les polymérases virales, et pouvant être étudiés : le Tegobuvir, ou encore le baloxavir marboxil (Xofluza) qui agit au niveau de l'ARN de la grippe et découpe une partie (cap) servant de primer initiant la copie de l'ARN. Le Silvestrol agit sur EIF4, un élément essentiel pour démarrer la copie de l'ARN (cap également).
Le monoxyde d'azote (NO) a montré une certaine efficacité pour bloquer la réplication de l'ancien sars-cov, notamment en réduisant une étape d'ajout de sucres au spicule (palmitoylation) et d'autre part en bloquant la protéase à cystéine codée par Orf1a du virus (essai clinique 1, 2, 3, 4, 5).
Le Zinc quant à lui est plutôt inefficace en théorie : il semble que la polymérase virale se lie au Zinc et aie donc besoin de cet élément pour fonctionner. En ajouter risque d'augmenter son activité.
Des candidats un peu plus étranges ont également été identifiés, ceux-ci sont spécifiques de virus à ADN ou d'autres types de virus, agissant sur leur réplication, mais n'ayant pas d'action théorique sur sars-cov-2 : Brincidofovir, Foscarnet, 4-HPR (Fenretinide), Emetine, Monensin, Isolanid (lanatoside C), Pentosan polysulfate, Tamoxifen, Suramin sodium, Niclosamide, Mitoxantrone
Parmi ces candidats, on note l'Ivermectine. Elle bloque les importines, molécules impliquées dans le transport vers le noyau. Elle fonctionne donc éventuellement pour certains virus à ADN, certains rétrovirus, mais les virus à ARN comme le sars-cov-2 n'ont pas besoin d'aller dans le noyau.
Un fort effet a été observé in vitro, mais celui-ci peut être dû à une cytotoxicité plutôt qu'à un effet réel sur le virus. Les auteurs ont proposé une explication liée aux interférons : les protéines virales seraient transportées dans le noyau où elles déclencheraient la production d'interférons. Dans cette hypothèse, le blocage des importines empêcherait le virus de neutraliser les défenses immunitaires de la cellule hôte.
Une étude rétrospective a donc été réalisée, portant sur 704 patients ayant reçu de l'ivermectine comparés à 704 patients tirés au hasard et ayant exactement les mêmes caractéristiques (âge sexe comorbidités etc...). La mortalité était bien inférieure (1.4% vs 8.5%) et le passage en respirateur également (7.3% vs 21.3%) dans le groupe traité.
Une étude rétrospective a donc été réalisée, portant sur 704 patients ayant reçu de l'ivermectine comparés à 704 patients tirés au hasard et ayant exactement les mêmes caractéristiques (âge sexe comorbidités etc...). La mortalité était bien inférieure (1.4% vs 8.5%) et le passage en respirateur également (7.3% vs 21.3%) dans le groupe traité.
Enfin une dernière technique consiste à ajouter des interférons qui permettent de perturber la réplication virale, par exemple Tilorone (Amixin) ou Novaferon.
4) Les candidats étranges
Parfois il y a aussi des candidats bien plus étranges comme la nicotine, ou encore la chlorpromazine. Au sein du pôle hospitalo-universitaire parisien du 15e arrondissement, alors qu’en moyenne 19% du personnel médico-soignant a contracté le COVID19, seuls 3 % des patients hospitalisés ont été dépistés positifs. C'est sur cette base très légère qu'il a été décidé de tester la chlorpromazine.
Elle présente pourtant un risque de QT long au niveau cardiaque. Elle a été identifiée in vitro dans un criblage de molécules, avec une certaine cytotoxicité et surtout un EC50 très élevé (concentration induisant une réponse à mi-chemin, 50%) :
La chlorpromazine semble même faciliter la fusion membranaire du virus... Son mécanisme d'action serait d'inhiber l'endocytose mais ce candidat reste tout de même étrange à tester en clinique sur une base aussi faible.
5) Des études combinées4) Les candidats étranges
Parfois il y a aussi des candidats bien plus étranges comme la nicotine, ou encore la chlorpromazine. Au sein du pôle hospitalo-universitaire parisien du 15e arrondissement, alors qu’en moyenne 19% du personnel médico-soignant a contracté le COVID19, seuls 3 % des patients hospitalisés ont été dépistés positifs. C'est sur cette base très légère qu'il a été décidé de tester la chlorpromazine.
Elle présente pourtant un risque de QT long au niveau cardiaque. Elle a été identifiée in vitro dans un criblage de molécules, avec une certaine cytotoxicité et surtout un EC50 très élevé (concentration induisant une réponse à mi-chemin, 50%) :
La chlorpromazine semble même faciliter la fusion membranaire du virus... Son mécanisme d'action serait d'inhiber l'endocytose mais ce candidat reste tout de même étrange à tester en clinique sur une base aussi faible.
Lorsqu'on associe plusieurs médicaments, on parle de bithérapies, trithérapies etc... Il est donc possible de combiner les effets de plusieurs médicaments soit pour cibler encore plus efficacement une étape de la réplication virale, soit pour limiter plusieurs des étapes essentielles décrites ci-dessus.
Une étude combinant le Kaletra (lopinavir/ritonavir), les interférons beta 1b et la rivarine a par exemple été publiée. Elle portait sur 86 patients traités et 41 dans un groupe contrôle n'ayant qu'un traitement lopinavir/ritonavir. Un effet sur la durée du séjour en hôpital et sur le score NEWS a été observé (A), mais il reste très peu concluant vu le faible effectif. Celui-ci était associé à une baisse de la charge virale dans différents prélèvements (B-E). La mesure de l'IL-6 a également permis de mesurer une légère différence au niveau de la réaction immunitaire (F).

6) L'approche interactome
Un gros travail a été réalisé en collaboration franco-américaine entre la fameuse University of California San-Francisco et l'institut Pasteur. Celui consiste à infecter des cellules avec les différentes protéines virales préalablement étiquetées, permettant ainsi de les isoler avec des anticorps (purification par affinité) et d'identifier les autres protéines liées à celles-ci. On appelle cela l'interactome. 332 protéines ont ainsi été identifiées comme étant des cibles thérapeutiques potentielles.
Ces protéines sont impliquées dans la réplication de l'ADN (Nsp1), régulation de l'expression des gènes (Nsp5, Nsp8, Nsp13, E), transport intracellulaire - vésicules (Nsp2, Nsp6, Nsp7, Nsp10, Nsp13, Nsp15, Orf3a, E, M, Orf8), modification de lipides (Spike), régulation et maturation de l'ARN (Nsp8, N), liaison à l'ubiquitine (Orf10), signalisation (Nsp8, Nsp13, N, Orf9b), transport nucléaire (Nsp9, Nsp15, Orf6), cytosquelette (Nsp1, Nsp13), mitochondrie (Nsp4,Nsp8, Orf9c), et matrice extracellulaire (Nsp9). C'est nsp5 qui semble inhiber la réponse de l'organisme par interférons en agissant sur HDAC2.
Deux familles de molécules ont été identifiées comme pouvant avoir des effets thérapeutiques :
- La synthèse protéique : zotatifin, ternatin-4, et PS3061
- Les ligands des récepteurs sigma1/sigma2 du réticulum endoplasmique : haloperidol, PB28, PD-144418 et hydroxychloroquine; les médicaments ciblant ces récepteurs clemastine, cloperastine, et progestérone; ainsi que la molécule de siramesine.
Pour la seconde catégorie, cependant, une étude a montré que l'effet in vitro observé pouvait être causé par un mécanisme de phospholipidose, impossible à reproduire in vivo... Les molécules cationiques amphiphiles nécessitent donc un contrôle supplémentaire lors de tels criblages.
De plus, des molécules comme la zotatifine ou la plitidespine ont été identifiées comme pouvant avoir une activité sur la réplication virale.




















0 commentaires:
Enregistrer un commentaire
Remarque : Seul un membre de ce blog est autorisé à enregistrer un commentaire.